题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在1393K下用H2(g)还原FeO(s),平衡时混合气体中H2(g)的摩尔分数为0.54。求FeO(s)的分解压。已知
在1393K下用H2(g)还原FeO(s),平衡时混合气体中H2(g)的摩尔分数为0.54。求FeO(s)的分解压。已知同温度下,2H2O(g)==2H2(g)+O2(g)KΘ=3.4×10-13。 (2)在炼铁炉中,氧化铁按如下反应还原:FeO(s)+CO(g)==Fe(S)+CO2(g),求:1393K下,还原1mol FeO需要CO多少摩尔?已知同温度下2CO2(g)--2CO(g)+O2(g)Ke=1.4×10-12。

 如搜索结果不匹配,请
如搜索结果不匹配,请 

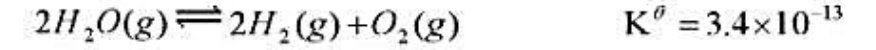
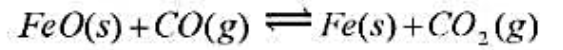
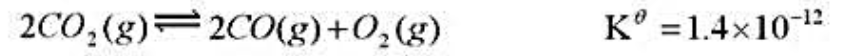
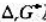 及
及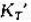 :
: