 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


已知0.1 mol/L的醋酸溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,并测得其在t ℃时Ka=b,下列说法中正确的是()
A.增大c(CH3COOH),b增大
B.加水稀释,b减小
C.的大小只与温度有关
D.以上说法均不对
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


A.增大c(CH3COOH),b增大
B.加水稀释,b减小
C.的大小只与温度有关
D.以上说法均不对
 更多“已知0.1 mol/L的醋酸溶液中存在如下电离平衡:CH3C…”相关的问题
更多“已知0.1 mol/L的醋酸溶液中存在如下电离平衡:CH3C…”相关的问题
A.0.5633
B.5.633
C.5.604
D.0.5604
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol/L
C.将1 L 0.1 mol/L的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
A.0.1 mol·L-1 CH3COOH溶液的pH=4,原因是CH3COOH可逆电离成 CH3COO-和H+
B.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
C.醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度
D.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
A.将等体积的pH分别为3和4的醋酸溶液完全中和时消耗氢氧化钠的物质的量,前者是后者的10倍
B.若H 2 A是二元弱酸,则0.1mol·L -1 NaHA溶液中:c
A.1.1×10-12 mol/L
B.1.1×10-11 mol/L
C.1.1×10-10 mol/L
D.1.1×10-8 mol/L
0.2 mol/L的氨水和0.2 mol/L等体积的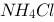 水溶液混合,溶液中的
水溶液混合,溶液中的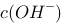 = ? mol/L。已知氨水的解离常数为
= ? mol/L。已知氨水的解离常数为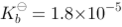
A、0.1
B、0.2
C、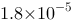
D、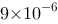
A.4.4×10-8
B.2.2×10-7
C.0.1
D.1.1×10-6
1.取含H2O2的试液25.00mL,置于250mL容量瓶中,加水稀释至刻度,摇匀。再吸取25.00mL,用H2SO4酸化,用c(1/5KMnO4)=0.01366 mol·L-1的KMnO4标准溶液滴定,消耗35.86 mL,试计算试样中H2O2的含量(g/L). 2.取维生素C(规格:50mg)20片,精密称重为1.9876 g,研细,精密称取细粉重0.4212g,置100mL量瓶中,加新煮沸过的冷水100mL与稀醋酸10ml的混合液70mL,振摇使溶解,并用混合液稀释至刻度,摇匀,经干燥滤纸迅速过滤,精密量取滤液50mL,加淀粉指示液1mL,用碘滴定溶液(0.1 mol·L-1)滴定,至溶液显蓝色并持续30秒不褪色。碘滴定液(0.1 mol·L-1)共消耗11.36ml。已知每1mL碘滴定溶液(0.1 mol·L-1)相当于维生素C为8.806 mg,,滴定溶液浓度校正因子为1.039。计算维生素C片中维生素含量占标示量的百分率。 3.取标示量为0.5 g的磺胺嘧啶片10片,总重为5.496g,研细,精密称出0.5367g,照磺胺嘧啶项下的方法测定,消耗亚硝酸钠标准滴定液(0.1 mol·L-1)19.25mL。每1mL亚硝酸钠滴定溶液(0.1 mol·L-1)相当于25.03mg的磺胺嘧啶,求该片剂按标示量表示的百分含量为多少? 1、3.33 2、98.09% 3、 98.68%


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题