 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
从标准电极电势分析下列反应向哪一方向进行? MnO2(s)+2Cl-(aq)+4H+(aq)→Mn2+(aq)+Cl2(g)+2H2O(l) 实验
从标准电极电势分析下列反应向哪一方向进行?
MnO2(s)+2Cl-(aq)+4H+(aq)→Mn2+(aq)+Cl2(g)+2H2O(l)
实验室往往利用该反应制备氯气,问应采取什么措施实现该反应?为什么?
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
从标准电极电势分析下列反应向哪一方向进行?
MnO2(s)+2Cl-(aq)+4H+(aq)→Mn2+(aq)+Cl2(g)+2H2O(l)
实验室往往利用该反应制备氯气,问应采取什么措施实现该反应?为什么?
 更多“从标准电极电势分析下列反应向哪一方向进行? MnO2(s)+…”相关的问题
更多“从标准电极电势分析下列反应向哪一方向进行? MnO2(s)+…”相关的问题
MnO2(s)+2Cl-(aq)+4H+(aq)====Mn2+(aq)+Cl2(g)+2H2O(1),实验中根据什么原理,采用什么措施,利用上述反应制备氯气?
A、E(Fe3+/ Fe2+)> E(I2/ I-)> E(Br2/ Br -)
B、E(I2/ I-)> E(Fe3+/ Fe2+)> E(Br2/ Br -)
C、E(Br2/ Br -)> E(I2/ I-)> E(Fe3+/ Fe2+)
D、E(Br2/ Br -)> E(Fe3+/ Fe2+)> E(I2/ I-)
 。
。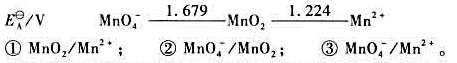
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势 和电池反应的
和电池反应的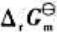 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势 和电池反应的
和电池反应的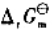 。
。
A、-0.153V
B、-0.184 V
C、0.153 V
D、0.184V
(1)化学反应的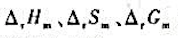 和电池电动势及电极电势值的大小,哪些与化学反应方程式的写法无关?
和电池电动势及电极电势值的大小,哪些与化学反应方程式的写法无关?
(2)为何H2S水溶液不能长期保存?
(3)能否用铁制容器盛放CuSO4溶液?
(4)配制SnCl2溶液时,为防止Sn2+被空气中氧所氧化,通常在溶液中加入少许Sn粒,为什么?
(5)铁溶于过量盐酸或过址稀硝酸,其氧化产物有何不同?
(6)为何金属Ag不能从稀H2SO4或盐酸中置换出H2,,却能从氢碘酸(HI)中置换出H2?
①O2/H2O2②O2/HO2-。
(2)试根据①和②的标准电极电势值及水的离子积常数求出H2O2的第一级解离常数。
KCl*O4Cu2*O Na2O2*s8*Na2S2*O3Na2S4*O6
O*F2K2Cr2*O7N2[*O N*H4+Pb3*O4AlN*


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题