 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列电对的 值:和CuCl的溶度积常数 ,试计算:(1)Cu+在水溶液中发生歧化反应的平衡常数:(2)
已知下列电对的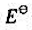 值:
值:
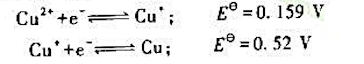
和CuCl的溶度积常数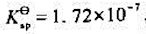 ,试计算:
,试计算:
(1)Cu+在水溶液中发生歧化反应的平衡常数:
(2)反应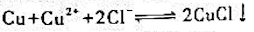 在298. 15 K时的平衡常数。
在298. 15 K时的平衡常数。
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列电对的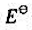 值:
值:
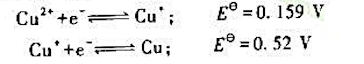
和CuCl的溶度积常数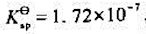 ,试计算:
,试计算:
(1)Cu+在水溶液中发生歧化反应的平衡常数:
(2)反应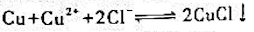 在298. 15 K时的平衡常数。
在298. 15 K时的平衡常数。
 更多“已知下列电对的 值:和CuCl的溶度积常数 ,试计算:(1)…”相关的问题
更多“已知下列电对的 值:和CuCl的溶度积常数 ,试计算:(1)…”相关的问题
已知下列标准电极电势:EΘ(Cu2+/Cu)=0.340V,EΘ(Cu2+/Cu+)=0.159V,Ksp(CuCl)=1.72×10-7,试计算下列反应的标准平衡常数: (1)Cu2++Cu=2Cu+; (2)Cu2++Cu+2Cl-=2CuCl(s)。
若已知25℃时Ni(OH)2饱和溶液的pH=9.20,试计算Ni(OH)2的标准溶度积常数为多少。
已知下列反应: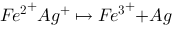 ,试计算: (1)反应的平衡常数
,试计算: (1)反应的平衡常数 ; (2)等体积混合1.0 mol/L的
; (2)等体积混合1.0 mol/L的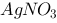 溶液和1.0 mol/L的
溶液和1.0 mol/L的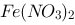 溶液,溶液中存在的各种离子的浓度。 已知:
溶液,溶液中存在的各种离子的浓度。 已知:
已知铟的元素电势图
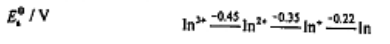

求:(1)In(OH)3的溶度积常数。
(2)In(OH)3(S)+3H+ In3++3H2O反应平衡常数。
In3++3H2O反应平衡常数。
(1)试写出下列各电对的电极反应式,并查表求出其电极电势值:
①O2/H2O2②O2/HO2-。
(2)试根据①和②的标准电极电势值及水的离子积常数求出H2O2的第一级解离常数。
已知下列元素电势图:
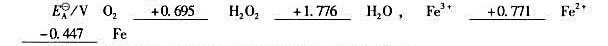
①H202能否发生歧化反应?如果能发生,写出反应式。
②在pH=3的条件下,判断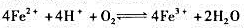 进行的方向。(设其他各离子浓度为1.0mol/L)。
进行的方向。(设其他各离子浓度为1.0mol/L)。
③计算298K时,反应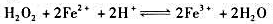 的平衡常数。(用
的平衡常数。(用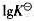 表示)
表示)
已知Ag2CO3的溶度积是8.46×10-12,若Ag2CO3在饱和溶液中完全解离,试计算
A.Cu2+/Cu+;
B.Cu2+/CuI;
C.Cu2+/CuBr;
D.Cu2+/CuCl。
已知下列元素电势图: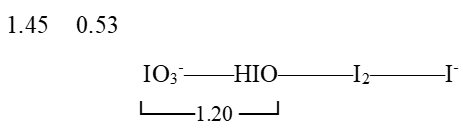 (1)计算: φƟ IO3-/I-=? φƟ IO3-/HIO=? (2)电势图中哪种物质能发生歧化反应,并写出反应方程式,计算反应的KƟ.
(1)计算: φƟ IO3-/I-=? φƟ IO3-/HIO=? (2)电势图中哪种物质能发生歧化反应,并写出反应方程式,计算反应的KƟ.


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题