题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知电极反应Cu2++2e-==Cu 的标准电极电势为0.342 V,则电极反应的标准电极电势为(
已知电极反应Cu2++2e-==Cu 的标准电极电势为0.342 V,则电极反应的标准电极电势为(
已知电极反应Cu2++2e-==Cu 的标准电极电势为0.342 V,则电极反应 的标准电极电势为()。
的标准电极电势为()。
A.0.684V
B.-0.684V
C.0.342V
D.-0.342V
提问人:网友13***002
发布时间:2022-01-07

 如搜索结果不匹配,请
如搜索结果不匹配,请 

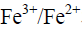 和
和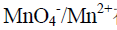 在25℃时电极电位分别为0.77 V和1.51 V,则用
在25℃时电极电位分别为0.77 V和1.51 V,则用 溶液滴定
溶液滴定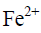 时,化学计量点时的电位应为( )
时,化学计量点时的电位应为( ) ,用两个电极组成原电池,电池符号为
,用两个电极组成原电池,电池符号为 ,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的
,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的 。
。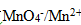 的标准电极电位φ=1.51V,当pH=3.0 时,它的条件电位为( )
的标准电极电位φ=1.51V,当pH=3.0 时,它的条件电位为( )