 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应:Zn+2H+(xmol·dm-3)=Zn2+(1mol·dm-3)+H2(100kpa)构成的原电池的电动势为0.46V,φθ(Zn2+/Zn)=- 0.76V,则pH值为。
A.10.2
B.2.5
C.3
D.5.1
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.10.2
B.2.5
C.3
D.5.1
 更多“反应:Zn+2H+(xmol·dm-3)=Zn2+(1mol…”相关的问题
更多“反应:Zn+2H+(xmol·dm-3)=Zn2+(1mol…”相关的问题
A、10.2
B、2.5
C、3
D、5.1
A、电动势
B、正极离子的浓度
C、电流
D、负极离子的浓度
1.以Pt为电极,电解含有Ag+(0.01moldm-3)和Cu2+(1mol dm-3)的硫酸盐。假定[H+]=1mol dm-3,已知氢在铂电极上的超电势为0.4V,氧在铂电极上的超电势为0.5V,求在阴极析出物质的先后顺序及开始析出物质时对应的槽压。 已知φϴAg+/ Ag = 0.799 V,φϴCu2+/ Cu = 0.337 V。 2. 298K时,欲回收电镀液中的银,废液中AgNO3浓度为10-6mol·L-1 ,还含有少量的Cu2+存在,若以石墨为阴极,银用阴极电解法回收,要求回收99%的银.计算中令活度系数γ1 =1。试计算:(1) Cu2+的浓度应低于多少?(2)阴极电位应控制在什么范围内?(3)什么情况下Cu与Ag同时析出? 3. 以惰性电极电解SnCl2的水溶液进行阴极镀Sn,阳极中产生O2,已知:αSn2+ = 0.10 , αH+ =0.010,阳极上ηO2 =0.50V,已知:φϴSn2+/Sn = -0.140V,φϴH+,H2O/O2 = 1.23V, (1)试写出电极反应,并计算实际分解电压,(2)若 φH2,阴=0.40V,试问要使αSn2+ 降低到何值时才开始析出氢? 注意:以上题目均不考虑氧分压。
A、1.0
B、4.25×10-16
C、1.81×10-31
D、0.86
(1)写出原电池符号、电池反应式;
(2)查标准电极电势表,求该原电池的标准电动势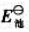 ;
;
(3)当电池反应进行到c(Cu2+)=1.0mol·dm-3时,试计算原电池的电动势E池。
Cu-Zn原电池的电池反应为Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s),电池符号为______。
A.(-)Zn(s)|CuSO4(c1)||ZnSO4(c2)|Cu(s)()
B.(-)ZnSO4(c1)|Zn(s)|"Cu(s)|CuSO4(c2)()
C.(-)Cu(s)||CuSO4(c1)|ZnSO4(c2)|Zn(s)()
D.(-)Zn(s)IZnSO4(c1)||CuSO4(c2)|Cu(s)()
A、-268.7kJ·mol-1
B、-177.8 kJ·mol-1
C、-119.9 kJ·mol-1
D、119.9 kJ·mol-1
A、c(Fe3+) < 1 mol·dm-3
B、c(Fe3+) > 1 mol·dm-3
C、c(Fe3+)/( Fe2+) < 1
D、c(Fe3+)/(Fe2+) > 1


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题