 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
根据下列分子或离子的几何构型,试用轨道杂化理论加以说明。

提问人:网友anonymity
发布时间:2022-01-06
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)

 更多“根据下列分子或离子的几何构型,试用轨道杂化理论加以说明。”相关的问题
更多“根据下列分子或离子的几何构型,试用轨道杂化理论加以说明。”相关的问题
(1)HgCl2(直线形);(2)SiF4(正四面体);(3)BCl3(平面三角形);
(4)NF3(三角锥形,102°);(5)NO2-(V形,115.4°);(6)SiF62-(八面体).
(1)O3;(2)NO3-;(3)AsI5;(4)NH3;(5)IF5;(6)POCl3;
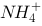 (7) CCl4 (8) CH4 (9)C2H4 (10) C2H2
(7) CCl4 (8) CH4 (9)C2H4 (10) C2H2


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题