 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


用浓度为cEDTA=0.0500mol·dm-3的溶液滴定100.0cm3浓度为的Zn2+,滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴
用浓度为cEDTA=0.0500mol·dm-3的溶液滴定100.0cm3浓度为
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


用浓度为cEDTA=0.0500mol·dm-3的溶液滴定100.0cm3浓度为
 更多“用浓度为cEDTA=0.0500mol·dm-3的溶液滴定1…”相关的问题
更多“用浓度为cEDTA=0.0500mol·dm-3的溶液滴定1…”相关的问题
用浓度为cEDTA=0.05000mol•L-1溶液滴定100.0mL浓度为cZn2+=0.0100mol•L-1的Zn2+,设滴定反应为: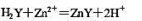 。滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴定至终点时,溶液的pH为多少?通过计算说明EDTA配位滴定时加入缓冲溶液的必要性。
。滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴定至终点时,溶液的pH为多少?通过计算说明EDTA配位滴定时加入缓冲溶液的必要性。
用浓度为CEDTA=0.05000mol·L-1溶液滴定100.0mL浓度为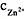 =0.0100mol·L-1的Zn2+,设滴定反应为
=0.0100mol·L-1的Zn2+,设滴定反应为

滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴定至终点时,溶液的pH为多少?通过计算说明EDTA配位滴定时加入缓冲溶液的必要性.
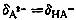 当pH=6.38时,
当pH=6.38时,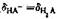 求滴定至第一化学计量点时,溶液的pH值是多少?()(用最简公式计算)
求滴定至第一化学计量点时,溶液的pH值是多少?()(用最简公式计算)A.8.32
B.10.25
C.6.38
D.7.00
A.0.0500mol/L
B.0.1000mol/L
C.0.2000mol/L
D.0.5000mol/L
E.1.0000mol/L
A.0.0500mol/L
B.0.1000mol/L
C.0.2000mol/L
D.0.5000mol/L
E.1.0000mol/L
A.0.600 (mmol/L)
B.0.300 (mmol/L)
C.0.060 (mmol/L)
D.0.030 (mmol/L)
取水样100mL于锥形瓶中,用c(1∕2H2SO4)=0.0500mol∕L硫酸标准溶液测定其碱度,以酚酞作指示剂时,水样不显色,但可加甲基橙指示剂继续用硫酸标准溶液滴定,消耗硫酸标准溶液6.00mL,则该水样中含有()碱度成分,其含量为(),该水样总碱度为()。
对硝基苯甲酸乙酯与NaOH在丙酮水溶液中反应:NO2(C6H4)COOC2H5+NaOH→NO2(C6H5)COONa+C2H5OH两种反应的初始浓度a均为0.0500mol·dm-3.在不同时刻测得NaOH的浓度(a-x)数据为:

(1)试用作图法证明是二级反应;(2)试求实验温度下的速率常数及半衰期.


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题