 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知Eq(Ce4+/Ce3+)=1.44V,Eq(Fe3+/Fe2+)=0.771V,则反应Ce3++Fe3+=Ce4++Fe2+在标准状态下进行的方向是( )。
A.反应迅速进行
B.逆向进行
C.正向进行
D.不能确定
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.反应迅速进行
B.逆向进行
C.正向进行
D.不能确定
 更多“已知(Ce4+/Ce3+)=1.44V,(Fe3+/Fe2+…”相关的问题
更多“已知(Ce4+/Ce3+)=1.44V,(Fe3+/Fe2+…”相关的问题
A.0.68V
B.1.44V
C.1.06V
D.0.86V
已知在lmol?L-1H2SO4溶液中ψθ(Ce4+/Ce3+)一1.44V,ψθ(Fe3-/Fe2+)=0.68V,在此条件下用0.1000mol?L-1Ce(SO4)2标准溶液滴定Fe2+,其计量点的电极电位值为()。
A.0.68V
B.1.44V
C.1.06V
D.2.12V
已知在1mol·L-1H2SO4溶液中,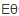 (Ce4+/Ce3+)=1.44V,
(Ce4+/Ce3+)=1.44V,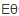 (Fe3+/Fe2+)=0.68V,在此条件下,用Ce(SO4)2标准溶液滴定Fe2+,其化学计量点的电位为______。
(Fe3+/Fe2+)=0.68V,在此条件下,用Ce(SO4)2标准溶液滴定Fe2+,其化学计量点的电位为______。
A .
A.0
B.50%
C.100%
D.200%
A.0.86~1.26V
B.0. 86~1.44V
C.0. 68~1.26V
D.0.68~1.4 V
A.2.12V
B.0.86V
C.1.06V
D.1.26V
已知在0.5mol/LH2SO4 介质中,φ(Ce4+/Ce3+)=1.44V,φ(Fe3+/Fe2+)=0.68V,计算此条件下以0.100mol/L Ce4+滴定 0.100mol/L Fe2+ 至化学计量点时,反应物及滴定产物的浓度()。 A. [Ce4+ ]=[Fe2+ ]=1.8×10 -8 mol/L,[Ce3+ ]=[Fe3+ ]≈0.050mol/L; B. [Ce4+ ]=[Fe3+ ]≈0.050mol/L,[Ce3+ ]=[Fe2+ ]=2.0×10 -8 mol/L; C. [Ce4+ ]=[Fe2+ ]=0.047mol/L,[Ce3+ ]=[Fe3+ ]=0.003mol/L; D. [Ce4+ ]=[Fe3+ ]=0.047mol/L,[Ce3+ ]=[Fe2+ ]=0.003mol/L
A、计量点时,Ce4+和Fe2+都已定量反应完毕,浓度都很小,以两电对电极电势方程式相加计算计量点电位;电极电势与浓度有关,详细见计算式。
B、计量点时,Ce4+和Fe2+都已定量反应完毕,浓度都很小,以两电对电极电势方程式相加计算计量点电位;电极电势与浓度有关,详细见计算式。
C、计量点时,Ce4+和Fe2+都已定量反应完毕,浓度都很小,以两电对电极电势方程式相加计算计量点电位;电极电势与浓度有关,详细见计算式。
D、计量点时,Ce4+和Fe2+都已定量反应完毕,浓度都很小,以两电对电极电势方程式相加计算计量点电位;电极电势与浓度有关,详细见计算式。


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题