 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在298K时,若将铜—锌原电池中Zn2+和Cu2+浓度均降为0.1mol.L—1,则此时原电池的电动势与标准态时比
A.下降0.48V
B.上升0.48V
C.下降0.24V
D.无变化
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.下降0.48V
B.上升0.48V
C.下降0.24V
D.无变化
 更多“在298K时,若将铜—锌原电池中Zn2+和Cu2+浓度均降为…”相关的问题
更多“在298K时,若将铜—锌原电池中Zn2+和Cu2+浓度均降为…”相关的问题
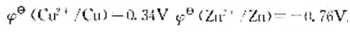 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()A.上升0.24V
B.下降0.24V
C.上升0.12V
D.下降0.12V
A.减少0.1184V
B.减少0.0592V
C.增大0.1184V
D.增大0.0592V
A.减小0.1184V
B.减小0.0592V
C.增大0.1184V
D.增大0.0592V
A、Zn2+与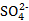 在溶液中的迁移速率不同,会产生电势差,两极之间形成液接电势
在溶液中的迁移速率不同,会产生电势差,两极之间形成液接电势
B、随着反应的进行,负极锌片周围的溶液带正电荷阻止锌失去电子变成Zn2+进入溶液,铜片周围的溶液带负电荷,阻止 Cu2+得到电子
C、在反应的过程中,锌片表面逐渐变得光滑,难以吸附电子
D、锌表面形成 “铜锌原子电池”
1.指出下列物质中画线元素的氧化数: NaH H2O2 KO2 KClO3 Na2S2O3 K2MnO4 Fe3O4 Mn2O7 K2Cr2O7 2.用氧化数法配平下列反应方程式 (1)MnO2+ HCl(浓)→ MnCl2 +Cl2 + H2O (2)KMnO4+ H2S + H2SO4→ MnSO4 + K2SO4+S +H2O (3)Cl2+ KOH → KCl +KClO3+ H2O (4)Cu+H2SO4(浓)→ CuSO4 +SO2 +H2O 3.将铁片和锌片分别浸入稀硫酸中,它们都被溶解并放出氢气。如果将它们同时浸入稀硫酸中,两端用导线连接,情况有何变化?说明理由。 4.为什么生铁在潮湿空气中比纯铁易腐蚀? 5.根据下列氧化还原反应各设计一个原电池,写出各原电池的电极反应,并用符号表示各原电池。 (1)Pb (NO3)2+ Mg→ Pb+Mg (NO3)2 (2)2FeCl3+ Cu →CuCl2+2FeCl2 6.现有镍片和1mol·L-1 Ni2+溶液,锌片和1mol·L-1 Zn2+溶液。问: (1)Ni、Ni2+、Zn2+、Zn中哪个是最强的氧化剂,哪个是最强的还原剂? (2)当金属镍放入1mol·L-1Zn2+溶液时,会有什么反应发生?当金属锌放入1 mol.L-1Ni2+溶液中呢? (3)以镍片和mol·L-1 Ni2+溶液构成一个半电池,锌片和1 mol·L-1Zn2+溶液构成另一个半电池,当这两个半电池相连,哪个电极是正极?哪个电极是负极?电池电动势是多少? 7.求下列电极在298K时的电极电势。 (1)金属铜放在0.50 mol.L-1的Cu2+离子溶液中; (2)当[Cr3+]=0.010mol·L-1,[Cr2O72-]=0.0010 mol·L-1,[H+]=0.10 mol·L-1时该电对的电极电势。 4.略 5.(1) (-)Mg∣Mg(NO3)2(c1)‖Pb(NO3)2(c2)∣Pb (+) 正极:Pb2++2 Pb 负极:Mg—2 Mg2+ (2)(-)Cu∣CuCl2(c1)‖FeCl3(c2), FeCl2(c3)∣Pt (+) 正极:2Fe3++2 2Fe2+ 负极:Cu—2 Cu2+ 6.(1) Ni2+,Zn (2) 无反应,Zn+Ni2+Ni+Zn2+ (3)正极是镍片,负极是锌片,0.517V 7.(1)0.328V (2) 1.102
A.1/10
B.1/100
C.10/1
D.100/1
A、因为电对 Ni2+ + 2 e- = Ni 的 jΘ = -0.23 v ,所以电对 2 Ni2+ + 4 e- = 2 Ni 的 jΘ = -0.46 v
B、含氧酸根的氧化能力通常随溶液的 pH值减小而增强
C、因为 jΘ(Cl2 / Cl-) > jΘ(MnO2 / Mn2+) ,所以不能用MnO2与盐酸作用制取氯气
D、已知 jΘ(Zn2+ / Zn) = -0.762 v ,jΘ(Cu2+ / Cu) = 0.347 v ,所以当铜锌原电池的电动势大于0时 ,Cu2+ 的浓度必定大于 Zn2+ 的浓度


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题