题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
给出合理解释: (1)Ga的第一电离能(578.8kJ.mol-1)比Al的第一电离能(577.5kJ.mol-)要高。
给出合理解释: (1)Ga的第一电离能(578.8kJ.mol-1)比Al的第一电离能(577.5kJ.mol-)要高。 (2)AlF3的熔点比AlCl3高得多。 (3)熔融的AlBr3不导电,而它的水溶液却是良导体。 (4)Tl(OH)与KOH的碱性一样。 (5)A1(Ⅲ)可以形成
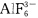 ,而B(Ⅲ)不能形成
,而B(Ⅲ)不能形成
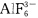 。 (6)能制得TlF3,但不能制得TlI3,却制得了TII。 (7)在蒸气下AlCl3为双聚体,而BCl3却不能发生二聚。 (8)TlI与KI同晶形,但TlI不溶于水。 (9)用路易斯酸碱理论和结构知识分析BF3和NH3作为酸碱的可能性。 (10)AlF3不溶于水,但可溶于HF中。 (11)BF3和BCl3中,哪一个是更好的电子接受体? (12)H3BO3在冷水中的溶解度很小,加热时,溶解度增大。 (13)BH3不存在,而BF3却能稳定存在。
。 (6)能制得TlF3,但不能制得TlI3,却制得了TII。 (7)在蒸气下AlCl3为双聚体,而BCl3却不能发生二聚。 (8)TlI与KI同晶形,但TlI不溶于水。 (9)用路易斯酸碱理论和结构知识分析BF3和NH3作为酸碱的可能性。 (10)AlF3不溶于水,但可溶于HF中。 (11)BF3和BCl3中,哪一个是更好的电子接受体? (12)H3BO3在冷水中的溶解度很小,加热时,溶解度增大。 (13)BH3不存在,而BF3却能稳定存在。
 参考答案
参考答案
 大π键BH3中H不能提供电子形成大π键表现强烈的缺电子性易聚合形成B2H6。
大π键BH3中H不能提供电子形成大π键表现强烈的缺电子性易聚合形成B2H6。(1)因为Ga位于第四周期,与Al相比,填充了3d电子层,3d电子疏松,屏蔽作用小,有效核电荷数大。同时按照松紧效应,Ga的4p电子处在“紧"的层,导致核对它的引力进一步增大,因此其第一电离能比Al的第一电离能要高。(2)AlF3为离子型化合物,A1Cl3为共价型化合物。(3)AlBr3为共价型化合物,熔融不导电;在水溶液中解离成自由离子,所以导电。(4)Tl+电荷/半径与K+相近。(5)形成需要sp3d2杂化轨道,B没有可以利用的d轨道,同时由于B半径小,周围容纳不下6个配位原子。(6)由于惰性电子对效应,Tl的稳定价态是+1价,Tl3+具有较强的氧化性强,F-几乎无还原性,而I-具有较强还原性,所以能制得TlF3,不能制得TlI3,只能制得TlI。(7)由于B的半径较小,空间条件限制,同时双聚需要破坏大π键,BCl3中大π键很强,不易破坏。(8)Tl+具有18+2电子结构,极化力强,同时又具有变形性,导致TlI共价特性明显,TlI难溶于水。(9)BF3缺电子,酸;NH3含孤对电子,碱。(10)AlF3晶格能很大,所以难溶于水,在HF中生成H3AlF6,所以溶解。(11)BCl3是更好的电子接受体。它们分子中存在大π键,接受电子需破坏大π键,BF3中的大π键强,难以破坏。(12)由于H3BO3晶体存在氢键,加热促进氢键断裂,溶解度增大。(13)BF3中的F可提供电子形成大π键,BH3中H不能提供电子形成大π键,表现强烈的缺电子性,易聚合形成B2H6。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案