 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。 (1)写出电池符号和电池反应方程式。 (2)计算电池电动势、电
标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。
(1)写出电池符号和电池反应方程式。
(2)计算电池电动势、电池反应的标准吉布斯自由能和平衡常数。
(3)在两电池溶液中同时加入S2-溶液,并使之都达到c(S2-)=1mol·L-1,求两电对的电极电势值,电池电动势和电池反应方向。
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。
(1)写出电池符号和电池反应方程式。
(2)计算电池电动势、电池反应的标准吉布斯自由能和平衡常数。
(3)在两电池溶液中同时加入S2-溶液,并使之都达到c(S2-)=1mol·L-1,求两电对的电极电势值,电池电动势和电池反应方向。
 更多“标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。 …”相关的问题
更多“标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。 …”相关的问题
A.0.1308 V
B.0.6993 V
C.-0.6993 V
D.-0.1308 V
A.向左
B.向右
C.维持现状
D.不能确定
若原电池:(-)Ni∣Ni2+(x mol×L-1)‖Sn2+(0.0010 mol×L-1)∣Sn() 的 电 动 势 E=0.00 V,已知j?(Ni2+/Ni)= - 0.257V,j?(Sn2+/Sn)= - 0.137V, 则该原电池的标准电动势E?=_________V,所发生的氧化还原反应为_____,DrGm?(298.15K) =___ ,K? (298.15 K)=___。Ni2+离子浓度 x =_______。
A.最强的氧化剂是Fe3+
B.最强的氧化剂是Ni2+
C.最强的还原剂是Ni
D.最强的氧化剂是Fe2+
A、因为电对 Ni2+ + 2 e- = Ni 的 jΘ = -0.23 v ,所以电对 2 Ni2+ + 4 e- = 2 Ni 的 jΘ = -0.46 v
B、含氧酸根的氧化能力通常随溶液的 pH值减小而增强
C、因为 jΘ(Cl2 / Cl-) > jΘ(MnO2 / Mn2+) ,所以不能用MnO2与盐酸作用制取氯气
D、已知 jΘ(Zn2+ / Zn) = -0.762 v ,jΘ(Cu2+ / Cu) = 0.347 v ,所以当铜锌原电池的电动势大于0时 ,Cu2+ 的浓度必定大于 Zn2+ 的浓度
已知原电池Cd|Cd2+(mol·L-1)‖Ni2+(2.00mol·L-1)|Ni的电动势E为0.200V,Φ(Cd2+/Cd)=-0.402V,Φ(Ni2+/Ni)=-0.23V,求电池中c(Cd2+)。
A.0.020 mol·L-1
B.0.320 mol·L-1
C.0.500 mol·L-1
D.0.12 mol·L-1
(1)它们组成原电池的电动势,并指出正负极。
(2)25℃时的标准平衡常数。
(3)反应的标准吉布斯函数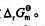
分析:本题主要考查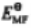 与
与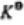 和
和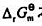 之间的换算关系。由于已经假设是在标准状下,所以不需要计算电极电势。
之间的换算关系。由于已经假设是在标准状下,所以不需要计算电极电势。
根据下列反应(假设离子浓度均为1.0molL-1) Ni(s)+Sn2+(aq)=Ni2+(aq)+Sn(s) Cl2(g)+2Br-1(aq)=Br2(l)+2Cl-(aq) 试分别计算: (1)它们组成的原电池电动势,并指出正负极。 (2)298K时的平衡常数。 (3)298K反应的标准吉布斯函数变△rGΘm。


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题