 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A、Ksp=[Fe3+][s2-]
B、Ksp=[Fe3+]2 [s2-] 3
C、Ksp=[2Fe3+]2[3s2-] 3
D、Ksp=2[Fe3+]2 ·3[s2-] 3
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 更多“Mg(OH)2的标准溶度积常数表达式为:KspӨ(Mg(OH…”相关的问题
更多“Mg(OH)2的标准溶度积常数表达式为:KspӨ(Mg(OH…”相关的问题
A、Ksp=[Fe3+][s2-]
B、Ksp=[Fe3+]2 [s2-] 3
C、Ksp=[2Fe3+]2[3s2-] 3
D、Ksp=2[Fe3+]2 ·3[s2-] 3
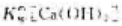 为()。
为()。A、5.0×10-7
B、2.0X10-6
C、4.0×10-6
D、8.0X10-6
A.S(AgSCN)=S(Ag2CrO4)
B.S(AgSCN)>(Ag2CrO4)
C.S(AgSCN)<S(Ag2CrO4)
D.2S(AgSCN)=S(Ag2CrO4)
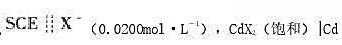 的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。
的电动势为-1.007V。计算CdX2的溶度积常数(不考虑液接电位,温度为25℃)。
A、无沉淀析出
B、有沉淀析出
C、析出沉淀后又溶解
D、不一定
A、1.0 mol·L-1 H2 SO4
B、1.0 mol·L-1 HCl
C、0.50 mol·L-1 NaOH
D、1.0 mol·L-1 NaOH
A、E=EӨ + (0.0592 V/ 4)lg {[c(H+)/cӨ]4·[c(HNO2)/cӨ]2/ [p(N2O)/pӨ]}
B、E=EӨ + (0.0592 V/ 4)lg {[c(H+)/cӨ]4·[c(HNO2)/cӨ]2 / [c(N2O)/cӨ]}
C、E=EӨ - (0.0592 V/ 4) lg[p(N2O)/pӨ]+ (0.0592 V/ 2) lg {[c(H+)/cӨ]2·[c(HNO2)/cӨ]}
D、E=EӨ - (0.0592 V/ 4)lg/[p(N2O)/pӨ] + (0.0592 V/2) lg[c(HNO2)/cӨ] - 0.0592 pH
A、Sn2+和Fe2+
B、Hg2+和Fe2+
C、Br2和Fe2+
D、Br2和Hg22+


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题