 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
电极电势
已知25℃时 .试计算25℃时电极Fe2+|Fe的标准电极电势
.试计算25℃时电极Fe2+|Fe的标准电极电势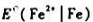 .
.
 .试计算25℃时电极Fe2+|Fe的标准电极电势
.试计算25℃时电极Fe2+|Fe的标准电极电势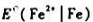 .
.请帮忙给出正确答案和分析,谢谢!
提问人:网友zouweijun
发布时间:2022-01-07
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 .试计算25℃时电极Fe2+|Fe的标准电极电势
.试计算25℃时电极Fe2+|Fe的标准电极电势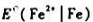 .
.请帮忙给出正确答案和分析,谢谢!
 更多“电极电势”相关的问题
更多“电极电势”相关的问题
A.0.2576V
B.0.279V
C.1.081V
D.1.777V
A、-142.8
B、142.8
C、-214.2
D、214.2
试计算25℃时反应

的标准平衡常数.当H2AsO3和I-的浓度为1.0mol·L-1.该反应正、负极电极电势相等时,溶液的pH为多少?
已知下列半电池反应及其标准电极电位为
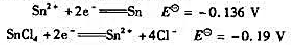
计算络合物平衡反应:
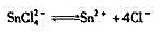 的不稳定常数。(25℃)
的不稳定常数。(25℃)
已知电极反应Cu2++2e-==Cu 的标准电极电势为0.342 V,则电极反应 的标准电极电势为()。
的标准电极电势为()。
A.0.684V
B.-0.684V
C.0.342V
D.-0.342V
25℃时标准银—氯化银电极的电位是()。
A.0.2223V
B.0.2223mV
C.0.2000V
D.0.2000mV
A.1.358
B.1.328
C.1.388
D.1.417


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题