 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
0.10 mol/L HCl介质中,用Fe3+滴定Sn2+,试计算化学计量点电位_.
提问人:网友orlan2000
发布时间:2022-01-06
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 更多“0.10 mol/L HCl介质中,用Fe3+滴定Sn2+,…”相关的问题
更多“0.10 mol/L HCl介质中,用Fe3+滴定Sn2+,…”相关的问题
在1mol/L H2SO4介质中用Ce4+滴定Fe2+,滴定突跃范围是______,化学计量点时的电位φsp=______,二苯胺磺酸钠______(合适或不合适)作指示剂。
A.1.06V
B.1.44V
C.0.85V
D.0.68V
用Ox1滴定Red2,氧化还原反应为:
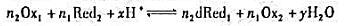
电对的电极反应及电极电位分别为:
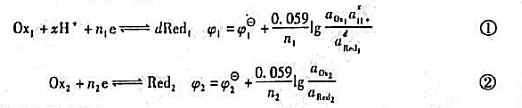
试证明化学计量点的电位为:
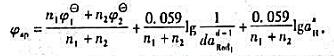
下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)为多少?
(a)在1mol·L-1HCL介质中,用Ce4+滴定Sn2+;
(b)在1mol·L-1H2SO4介质中,用Fe3+滴定UIV;
(c)在lmol·L-1H2SO4介质中,用Ce4+滴定vo2+.
A.偏向MnO4-/Mn2+电对一边
B.偏向Fe3+/Fe2+电对一边
C.在两电对电位的正中间
D.等于两电对的电位差


为了保护您的账号安全,请在“简答题”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 简答题
简答题



 微信搜一搜
微信搜一搜
 简答题
简答题